Les tests de santé

Les bergers américains miniatures sont généralement des chiens en bonne santé, et les éleveurs responsables testent leurs chiens pour vérifier leur état de santé et communiquent avec d'autres éleveurs pour travailler ensemble à la santé de la race et à la préservation des qualités uniques de la race. Des visites régulières chez le vétérinaire pour les examens et le contrôle des parasites aident à assurer au chien une vie longue et saine.
Assurez-vous que les parents de votre futur chien soient bien testés pour les différentes maladies chroniques ou génétiques.
Les maladies génétiques

Les maladies génétiques :
Des tests génétiques existent pour déterminer si un sujet est génétiquement :
Porteur, Non atteint : +/- ou N/P
Porteur, atteint : -/- ou P/P
Pour l'HSF4-A, l'AOC, PRA-prcd, APR, MDR1, DM, HUU, CMR1, CPDA, CDDY-IVDD, NAD :
Un sujet -/- ne devrait pas être reproduit ou alors avec un sujet +/+.
La Cataracte Héréditaire (HSF4 - A) :
La cataracte est l'opacification du cristallin, structure de l'œil normalement transparente située derrière l'iris.
L'opacité sur le cristallin due à la cataracte empêche les rayons d'atteindre la rétine.
Chez le Berger Australien, deux types majeurs de cataractes ont été observés. La première est juvénile et évolue rarement vers une détérioration de la vision (localisation sous capsulaire postérieure). La seconde, plus sévère, peut affecter la vision (localisation proche du noyau).
La transmission est autosomique donc les sujets +/- peuvent développer la maladie.
Tout chien porteur devra être dépiste régulièrement pour les MOHC, suivi par un vétérinaire ophtalmologue et devra être reproduit avec un chien +/+.
La cataracte est l’un des problèmes héréditaires les plus courants chez les bergers australiens et certainement la maladie oculaire héréditaire la plus courante de cette race. Le signe clinique typique est l’opacité du cristallin qui conduit à la cécité. La forme primaire/héréditaire de la maladie est présente dans environ 100 races de chiens, mais malgré sa fréquence, les bases génétiques sont mal comprises. À ce jour, seul le gène HSF4 était associé à la cataracte héréditaire chez le chien et est également responsable du développement de la maladie chez les bergers australiens, les Boston Terriers, les Staffordshire Bull Terriers et les bouledogues français.
La transmission de la maladie est relativement complexe en raison de son mode autosomique dominant et de sa pénétrance incomplète, ce qui signifie que tous les animaux hétérozygotes ne développent pas la maladie. La manifestation clinique varie considérablement. Des changements pathologiques se développent sur différentes parties du cristallin, l’apparition de la maladie varie du jeune adulte au seuil de la vieillesse, et la progression de la maladie est également très variable. Ces faits indiquent que d’autres facteurs génétiques et environnementaux encore inconnus contribuent au développement de la maladie. Selon la littérature scientifique, la probabilité de développer la maladie est 17 fois plus élevée chez les animaux hétérozygotes HSF4 que chez les animaux HSF4 clairs. Le test ne peut exclure d’autres anomalies génétiques pouvant être impliquées dans le développement de la cataracte héréditaire chez les bergers australiens.
Héritage : autosomique dominant (pénétrance incomplète) - Berger Australien - en savoir plus ;
Mutation : gène HSF4
Test génétique : La méthode utilisée pour les tests est extrêmement précise et permet une différenciation complète entre les animaux atteints, les porteurs et les chiens sains. Les tests peuvent être effectués à tout âge.
Contrôle de maladie:
Berger Australien : La maladie étant autosomique dominante avec une pénétrance incomplète, elle se manifestera chez la plupart des animaux porteurs d'au moins un gène muté. Ces animaux hétérozygotes présenteront des signes cliniques qui diminueront leur qualité de vie. Dans le but d'éradiquer la maladie, il n'est pas conseillé d'élever des animaux atteints ou porteurs.
L'Anomalie de l'Œil du Colley (A O C) :
L'AOC ne touche pas que le Colley, mais aussi les races apparentées. Connue également sous le nom d’hypoplasie choroïdienne, cette maladie héréditaire cause un développement anormal de la choroïde (tissu présent sous la rétine). Cette maladie présente une grande variabilité de signes cliniques entre les races touchées et entre les individus d’une même race. De plus, il n’existe pas de traitement curatif.
Il existe en fait 5 niveaux de lésions et dont les conséquences sur la vision sont très variables.
Stade 1 : Petites zones d'hypoplasie choroïdienne : problèmes optiques mineurs
Stade 2 : Hypoplasie choroïdienne
Stade 3 : Colobome
Stade 4 : Décollement de rétine
Stade 5 : Hémorragie intraoculaire : cécité
AOC - Anomalie de l'Oeil du Colley (hypoplasie choroïdienne) est une maladie héréditaire de l'œil. Elle est caractérisée par une atteinte régionale de la choroïde (la couche de l'œil approvisionnant la rétine en sang et substances nutritives) qui se forme au cours du développement de l'œil. La maladie peut être légère ou grave. Les animaux qui souffrent de la forme légère maintiennent la vision normale. Cependant, chez les animaux qui soufrent des formes plus graves, la hypoplasie et le décollement de la rétine peuvent se produire, ce qui entraine la cécité. Parce que la maladie survient au cours du développement de l'œil, elle n'est pas progressive et, une fois le développement fini, son état est stable. La maladie peut être diagnostiquée par un examen ophtalmologique à l'âge de 5-10 semaines. Après le 12ème semaine, le diagnostic est plus difficile jusqu'à l'apparition des signes cliniques parce que le pigment est imbriqué. L'examen ophtalmologique peut détecter les animaux malades mais pas les porteurs.
Hérédité : autosomique récessive
Mutation : gène NHEJ1
Test génétique : Les porteurs de la maladie peuvent être identifiés à tout âge. La méthode PCR qui s'utilise pour l'essai est une méthode très précise permettant de distinguer entre les animaux touchés, porteurs et animaux sains.
L'Atrophie Progressive de la Rétine (PRA-prcd) :
Est une dégénérescence des cônes et bâtonnets dans la rétine. Tous les sujets atteints finiront totalement aveugle.
Le premier symptôme est la cécité nocturne.
Deux formes d'Atrophie Progressive de la Rétine existent : l'APR juvénile, Sous-développement des cônes et bâtonnets de la rétine, les symptômes apparaissent dès l’âge de 12 semaines et le chien sera aveugle avant 2 ans.
L'autre forme se développe lorsque le chien a 4-7 ans et est liée à une dégénérescence des cônes et bâtonnets de la rétine.
Les premiers symptômes toucheront également la vision nocturne Le temps entre les premiers symptômes et la cécité totale sont variables d'un individu à l'autre.
L'atrophie progressive de la rétine est une maladie héréditaire qui apparaît chez plusieurs races de chiens et se manifeste sous formes différentes. La forme de la dégénérescence progressive des cônes et des bâtonnets est une dégénérescence des photorécepteurs chez les chiens qui apparaît à différents âges. La malformation génétique provoque la dégénérescence des cellules rétiniennes dans l'œil. Tout d'abord, les cellules des cônes sont touchées, entraînant la cécité nocturne. Puis, les cellules des bâtonnets sont touchées, ce qui a pour conséquence la cécité complète même dans les conditions optimales d'éclairage (de jour). Typiquement, la maladie apparaît à un jeune âge ou au début de l'âge adulte. Néanmoins, le moment d'apparition peut varier en fonction de la race du chien.
Hérédité : autosomique récessive ; pour en savoir plus
Mutation : gène PRCD
Test génétique : Les porteurs de la maladie peuvent être identifiés à tout âge. La méthode PCR qui s'utilise pour l'essai est une méthode très précise permettant de distinguer entre les animaux touchés, porteurs et animaux sains.
La Myélopathie Dégénérative (DM) :
La dégénérescence progressive des neurones en région thora colombaire est responsable d’une ataxie et d’une parésie, associée à divers symptômes nerveux comme une diminution des réflexes et du tonus musculaire, le tout évoluant lentement vers une paralysie flasque du train postérieur. (Sources Laboklin).
La Myélopathie Dégénérative (Dégénérative Myélopathie) atteint les chiens âgés, parfois dès de 8 ou 10 ans, mais plutôt entre 10 et 12 ans.
La myélopathie dégénérative (DM) canine est un trouble de la moelle épinière à évolution lente, spontané et apparaissant à l'âge adulte. Les signes cliniques apparaissent à partir de 8 ans et débutent par une ataxie proprioceptive générale asymétrique et une parésie spastique des membres postérieurs. Un an après l'apparition des signes cliniques, les chiens deviennent généralement paraplégiques et de nombreux propriétaires choisissent donc l'euthanasie. Si les propriétaires décident de reporter l'euthanasie, une progression de la maladie est observée, notamment une faiblesse des membres thoraciques, une tétraplégie flasque, une atrophie musculaire généralisée et une dysphagie. La maladie survient avec la même fréquence chez les chiens mâles et femelles.
Récemment, une mutation de l'exon 2 du gène SOD1 a été associée au développement de la maladie chez de nombreuses races de chiens. Une mutation homozygote est observée chez la plupart des chiens présentant des cas de myélopathie dégénérative confirmés cliniquement et histopathologiquement. Certains chiens hétérozygotes ont développé une DM plus tard dans la vie, ce qui concorde avec le mode de transmission de l'homologue humain de la sclérose latérale amyotrophique (SLA).
Héritage : autosomique récessif - en savoir plus
Mutation : gène SOD1 (exon 2)
Test génétique : La méthode utilisée pour les tests est extrêmement précise et permet une différenciation complète entre les animaux atteints, les porteurs et les chiens sains. Les tests peuvent être effectués à tout âge.
Hyperuricosurie (HUU) :
C'est un trouble du métabolisme entraînant un excès d’acide urique dans le sang et l’urine et qui prédispose à la formation de cristaux d’urate ou calculs urinaires. L'animal rencontre des difficultés à uriner, une présence de sang dans les urines, incontinence urinaire, douleurs abdominales. Certaines complications sont possibles : insuffisance rénale aigüe, infection du tractus urinaire, ou rupture de la vessie.
La maladie est causée par la mutation G563T dans le gène SLC2A9 qui code la protéine assurant le transport de l'acide urique exprimée dans les reins d'animaux. La mutation a été trouvée pour la première fois chez les Dalmatiens, or une dépistage généralisée a démontré qu'elle est aussi fréquemment présente chez les Bouledogues, les Terriers noirs russes et les Staffordshire terriers américains. La mutation apparaît aussi chez les Retrievers et autres races
Hérédité : autosomique récessive - pour en savoir plus
Mutation : gène SLC2A9
Test génétique : Les porteurs de la maladie peuvent être identifiés à tout âge. La méthode PCR qui s'utilise pour l'essai est une méthode très précise permettant de distinguer entre les animaux touchés, porteurs et animaux sains.
Rétinopathie Multifocale (CMR1) :
Décollement de la rétine en plusieurs endroits, responsable d'une dégénérescence de la rétine pouvant s'étendre par regroupement des lésions. Dans les formes les moins graves, le chien ne semble pas présenter de problèmes de vision malgré l’apparence anormale de la rétine. Dans les formes les plus graves, les lésions peuvent conduire à la cécité. La maladie se déclare avant 4 mois chez un sujet porteur / atteint (-/-).
La rétinopathie multifocale canine (CMR1) est une maladie oculaire génétique autosomique récessive similaire à la dystrophie maculaire Best chez l'homme. La mutation causale du gène BEST1 génère un codon d'arrêt prématuré, qui aboutit à une protéine non fonctionnelle responsable de la formation appropriée de l'épithélium pigmentaire dans la rétine. Les signes cliniques typiques incluent des zones multifocales d'élévation de la rétine qui évoluent vers des zones multifocales d'atrophie rétinienne externe. Chez les animaux atteints, la maladie se développe avant l’âge de 4 mois et peut progresser lentement. Certains animaux atteints ne présentent des symptômes que plus tard dans leur vie.
Héritage : autosomique récessif
Mutation : gène BEST1
Test génétique : La méthode utilisée pour les tests est extrêmement précise et permet une différenciation complète entre les animaux atteints, les porteurs et les chiens sains. Les tests peuvent être effectués à tout âge.
La sensibilité Médicamenteuse (MDR1) :
Les chiens de type colley et races apparentées présentent une mutation génétique dans le gène MDR1. Lorsque le chien porte cette mutation, certains médicaments s’accumulent dans le cerveau et deviennent toxiques jusqu’à provoquer une forte intoxication et éventuellement la mort de l’animal.
Une étude a permis de préciser que 58 % des Bergers australien peuvent être sensible.

Les molécules à proscrire :
Ivermectine, Emodepside, Lopéramide, Moxidectine, Doramectine, Abamectine
Il est vivement conseillé de prendre autant de précautions avec les chiens hétérozygotes qu’avec les chiens homozygotes mutés.
Les signes cliniques
Après l’administration d’un médicament à risque, en fonction de la dose, un chien sensible présente un syndrome neurodépresseur avec les signes cliniques suivants : ataxie, prostration, parésie, hyper salivation, mydriase, amaurose, tremblements, convulsions pouvant conduire au coma ou à la mort par dépression respiratoire.
Mutation: gène MDR1
Test génétique : Les porteurs de la maladie peuvent être identifiés à tout âge. La méthode PCR qui s'utilise pour l'essai est une méthode très précise permettant de distinguer entre les animaux touchés, porteurs et animaux sains.
Chondrodysplasie et dystrophie risque d‘hernie discale (CDPA/CDDY-IVDD) :
Héritage : autosomique dominant - en savoir plus
Mutation : gène FGF4
Test génétique : La méthode utilisée pour les tests est extrêmement précise et permet une différenciation complète entre les animaux atteints, les porteurs et les chiens sains. Les tests peuvent être effectués à tout âge.
Dystrophie neuroaxonale (NAD) :
Une maladie neurologique héréditaire appelée dystrophie neuroaxonale (NAD) a été signalée chez les chiens de berger américain miniature, de berger australien miniature et de berger australien jouet aux États-Unis et en Europe. Les cas ont été confirmés par une autopsie réalisée par des neuropathologistes vétérinaires certifiés.
L'âge d'apparition se situe généralement chez les jeunes chiens adultes (âgés de 2 à 4 ans), ce qui est regrettable, car les chiens peuvent avoir été élevés avant que l'on sache qu'ils sont affectés. Les signes cliniques commencent très légèrement, notamment une position arrière large et une démarche anormale intermittente, commençant dans les membres pelviens. Ils peuvent avoir des difficultés à monter les escaliers ou à sauter sur des hauteurs qui ne devraient normalement pas poser de problème. Les signes progresseront et s’aggraveront lentement, mais insidieusement, avec le temps. Les membres pelviens peuvent glisser, entraînant des blessures sur le dessus du pied. Finalement, le chien démontrera constamment une démarche anormale et les membres thoraciques seront également affectés. Les membres thoraciques présentent généralement une démarche « à pas élevés ». D'autres signes cliniques peuvent inclure : des tremblements de tête, une abrutissement mental, des problèmes de vision, une incontinence urinaire et fécale (périodique évoluant vers une permanente), une paralysie laryngée et autres. La vitesse et la gravité de la progression de ces signes dictent en fin de compte la qualité de vie du chien et peuvent nécessiter une euthanasie sans cruauté si le chien ne peut pas marcher seul.
L'autopsie du système neurologique révèle des changements pathologiques dans tout le cerveau (y compris le cerveau et le cervelet) et la moelle épinière.
Des recherches menées à l'Université Purdue, en parallèle avec des chercheurs de l'Université de Pennsylvanie et de l'Université de Berne (en Suisse), indiquent que cette maladie est héréditaire de manière autosomique récessive. Nous avons identifié une mutation au sein d'un gène associé à la maladie, et tous les chiens affectés possèdent deux copies de cette mutation. Nous proposons désormais un test génétique qui permet aux propriétaires de déterminer le statut de leur chien pour cette mutation (clair, porteur ou atteint) afin de diagnostiquer les chiens atteints et d'orienter les futures décisions d'élevage. Il n’est pas nécessaire de retirer les porteurs de la population reproductrice ; cependant, ils ne doivent être élevés que pour éliminer les partenaires afin d'éviter de produire une progéniture affectée.
Héritage : autosomique récessif
Test génétique : La méthode utilisée pour les tests est extrêmement précise et permet une différenciation complète entre les animaux atteints, les porteurs et les chiens sains. Les tests peuvent être effectués à tout âge.
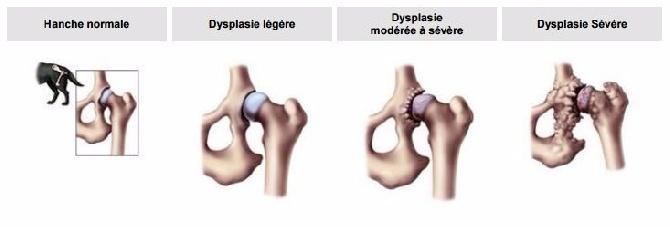
La dysplasie de la hanche frappe surtout les chiens de moyenne et grande taille. Le poids du chien augmente également le facteur de risque : les Saint-Bernard présentent ainsi un risque plus élevé de dysplasie que chez le Berger allemand par exemple.
Cette maladie ayant une composante héréditaire, il est indispensable d’empêcher les sujets porteurs de se reproduire, qu’ils soient mâles ou femelles. L’information et la prévention dans cette affection canine ont grandement contribué à améliorer la situation : tous les éleveurs aujourd’hui sont sensibilisés à ce problème et ne se risqueront jamais à faire reproduire un chien dysplasique. Mais cela ne suffit pas : d’une part parce que le gène héréditaire est très complexe (il semblerait, de fait, que la dysplasie ne dépende pas d’un seul gène mais de l’influence combinée de plusieurs gènes) et d’autre part parce que le facteur héréditaire n’est pas seul en cause. On relève des facteurs liés à l’environnement, à l’alimentation et à des chocs traumatiques pouvant favoriser l’apparition de cette maladie chez le chien.
La radiographie doit être effectuée à partir de 12 mois et pas avant pour les Mini australiens, la lecture doit se faire par un lecteur officiel.
Les résultats varient de A/A (très bon) à E/E (très mauvais).
Un reproducteur C/C ne doit être reproduit qu'avec un A/A.
Les sujets D/D et E/E ne doivent pas être reproduit.
Trouver le Résultat Génétique de son chiot par parenté (affiliation)








